Constanta k. Ludwig Boltzmann: Realizări personale
Ca știință cantitativă exactă, fizica nu se poate lipsi de un set de constante foarte importante care sunt incluse ca coeficienți universali în ecuații care stabilesc relații între anumite cantități. Acestea sunt constante fundamentale, datorită cărora astfel de relații devin invariante și sunt capabile să explice comportamentul sistemelor fizice la diferite scări.
Printre astfel de parametri care caracterizează proprietățile inerente materiei Universului nostru se numără constanta Boltzmann, mărime inclusă într-un număr dintre cele mai importante ecuații. Cu toate acestea, înainte de a trece la o analiză a trăsăturilor și semnificației sale, nu se poate să nu spună câteva cuvinte despre omul de știință al cărui nume îl poartă.
Ludwig Boltzmann: realizări științifice
Unul dintre cei mai mari oameni de știință ai secolului al XIX-lea, austriacul Ludwig Boltzmann (1844-1906) a adus o contribuție semnificativă la dezvoltarea teoriei cinetice moleculare, devenind unul dintre creatorii mecanicii statistice. El a fost autorul ipotezei ergodice, o metodă statistică în descrierea unui gaz ideal și al ecuației de bază a cineticii fizice. A lucrat mult pe probleme de termodinamică (teorema H a lui Boltzmann, principiul statistic pentru a doua lege a termodinamicii), teoria radiațiilor (legea Stefan-Boltzmann). În lucrările sale, a atins, de asemenea, unele probleme de electrodinamică, optică și alte ramuri ale fizicii. Numele său este imortalizat în două constante fizice, care vor fi discutate mai jos.
Ludwig Boltzmann a fost un susținător convins și consecvent al teoriei structurii atomo-moleculare a materiei. Timp de mulți ani, a trebuit să se lupte cu neînțelegerea și respingerea acestor idei în comunitatea științifică a vremii, când mulți fizicieni considerau atomii și moleculele ca o abstractizare inutilă, în cel mai bun caz un dispozitiv convențional pentru confortul calculelor. O boală dureroasă și atacurile colegilor conservatori l-au provocat pe Boltzmann într-o depresie severă, care, incapabil să suporte, l-a determinat pe remarcabilul om de știință să se sinucidă. Pe monumentul mormânt, deasupra bustului lui Boltzmann, în semn de recunoaștere a meritelor sale, este gravată ecuația S = k∙logW - unul dintre rezultatele muncii sale științifice fructuoase. Constanta k din această ecuație este constanta lui Boltzmann.
Energia moleculelor și temperatura materiei
Conceptul de temperatură servește la caracterizarea gradului de încălzire a unui anumit corp. În fizică, se utilizează o scară de temperatură absolută, care se bazează pe concluzia teoriei cinetice moleculare despre temperatură ca măsură care reflectă cantitatea de energie a mișcării termice a particulelor unei substanțe (adică, desigur, energia cinetică medie a un set de particule).
Atât joule SI, cât și erg utilizate în sistemul CGS sunt unități prea mari pentru a exprima energia moleculelor, iar în practică a fost foarte dificil să se măsoare temperatura în acest fel. O unitate convenabilă de temperatură este gradul, iar măsurarea este efectuată indirect, prin înregistrarea caracteristicilor macroscopice în schimbare ale unei substanțe - de exemplu, volumul.

Cum se leagă energia și temperatura?
Pentru a calcula stările materiei reale la temperaturi și presiuni apropiate de normal, se folosește cu succes modelul unui gaz ideal, adică unul a cărui dimensiune moleculară este mult mai mică decât volumul ocupat de o anumită cantitate de gaz și distanța dintre particulele depășesc semnificativ raza interacțiunii lor. Pe baza ecuațiilor teoriei cinetice, energia medie a unor astfel de particule este determinată ca E av = 3/2∙kT, unde E este energia cinetică, T este temperatura și 3/2∙k este coeficientul de proporționalitate introdus de Boltzmann. Numărul 3 caracterizează aici numărul de grade de libertate a mișcării de translație a moleculelor în trei dimensiuni spațiale.
Valoarea k, care a fost numită mai târziu constanta Boltzmann în onoarea fizicianului austriac, arată cât de mult dintr-un joule sau erg conține un grad. Cu alte cuvinte, valoarea sa determină cât de mult crește statistic energia mișcării haotice termice a unei particule dintr-un gaz ideal monoatomic, în medie, cu o creștere a temperaturii cu 1 grad.

De câte ori este un grad mai mic decât un joule?
Valoarea numerică a acestei constante poate fi obținută în diferite moduri, de exemplu, prin măsurarea temperaturii și presiunii absolute, folosind ecuația gazului ideal sau folosind un model de mișcare brownian. Derivarea teoretică a acestei valori la nivelul actual de cunoștințe nu este posibilă.
Constanta lui Boltzmann este egală cu 1,38 × 10 -23 J/K (aici K este kelvin, un grad pe scara de temperatură absolută). Pentru un grup de particule dintr-un mol de gaz ideal (22,4 litri), coeficientul care raportează energia la temperatură (constanta universală a gazului) se obține prin înmulțirea constantei lui Boltzmann cu numărul lui Avogadro (numărul de molecule dintr-un mol): R = kN A și este 8,31 J/(mol∙kelvin). Cu toate acestea, spre deosebire de aceasta din urmă, constanta Boltzmann este mai universală în natură, deoarece este inclusă în alte relații importante și servește și la determinarea unei alte constante fizice.
Distribuția statistică a energiilor moleculare
Deoarece stările macroscopice ale materiei sunt rezultatul comportării unei colecții mari de particule, ele sunt descrise folosind metode statistice. Acesta din urmă include, de asemenea, aflarea modului în care sunt distribuiți parametrii energetici ai moleculelor de gaz:
- Distribuția maxwelliană a energiilor (și vitezelor) cinetice. Ea arată că într-un gaz aflat în stare de echilibru, majoritatea moleculelor au viteze apropiate de viteza cea mai probabilă v = √(2kT/m 0), unde m 0 este masa moleculei.
- Distribuția Boltzmann a energiilor potențiale pentru gazele situate în câmpul oricăror forțe, de exemplu, gravitația Pământului. Depinde de relația dintre doi factori: atracția către Pământ și mișcarea termică haotică a particulelor de gaz. Ca urmare, cu cât energia potențială a moleculelor este mai mică (mai aproape de suprafața planetei), cu atât concentrația lor este mai mare.

Ambele metode statistice sunt combinate într-o distribuție Maxwell-Boltzmann care conține un factor exponențial e - E/ kT, unde E este suma energiilor cinetice și potențiale, iar kT este energia medie deja cunoscută a mișcării termice, controlată de constanta Boltzmann.
Constanta k și entropia
Într-un sens general, entropia poate fi caracterizată ca o măsură a ireversibilității unui proces termodinamic. Această ireversibilitate este asociată cu disiparea - disiparea - energiei. În abordarea statistică propusă de Boltzmann, entropia este o funcție a numărului de moduri în care un sistem fizic poate fi realizat fără a-și schimba starea: S = k∙lnW.
Aici constanta k specifică scara creșterii entropiei cu o creștere a acestui număr (W) de opțiuni de implementare a sistemului sau microstări. Max Planck, care a adus această formulă în forma ei modernă, a sugerat să dea constantei k numele Boltzmann.

Legea radiației Stefan-Boltzmann
Legea fizică care stabilește modul în care luminozitatea energetică (puterea radiației pe unitatea de suprafață) a unui corp absolut negru depinde de temperatura acestuia are forma j = σT 4, adică corpul emite proporțional cu puterea a patra a temperaturii sale. Această lege este folosită, de exemplu, în astrofizică, deoarece radiația stelelor este apropiată ca caracteristici de radiația corpului negru.
În această relație există o altă constantă, care controlează și amploarea fenomenului. Aceasta este constanta Stefan-Boltzmann σ, care este de aproximativ 5,67 × 10 -8 W/(m 2 ∙K 4). Dimensiunea sa include kelvins - ceea ce înseamnă că este clar că constanta Boltzmann k este implicată și aici. Într-adevăr, valoarea lui σ este definită ca (2π 2 ∙k 4)/(15c 2 h 3), unde c este viteza luminii și h este constanta lui Planck. Deci constanta Boltzmann, combinată cu alte constante ale lumii, formează o cantitate care conectează din nou energia (puterea) și temperatura - în acest caz în raport cu radiația.

Esența fizică a constantei Boltzmann
S-a menționat deja mai sus că constanta lui Boltzmann este una dintre așa-numitele constante fundamentale. Ideea nu este doar că ne permite să stabilim o legătură între caracteristicile fenomenelor microscopice la nivel molecular și parametrii proceselor observate în macrocosmos. Și nu numai că această constantă este inclusă într-o serie de ecuații importante.
În prezent nu se știe dacă există vreun principiu fizic pe baza căruia ar putea fi derivat teoretic. Cu alte cuvinte, nu rezultă din nimic că valoarea unei constante date ar trebui să fie exact aceea. Am putea folosi alte cantități și alte unități în loc de grade ca măsură a conformității cu energia cinetică a particulelor, atunci valoarea numerică a constantei ar fi diferită, dar ar rămâne o valoare constantă. Alături de alte mărimi fundamentale de acest fel - viteza limită c, constanta Planck h, sarcina elementară e, constanta gravitațională G - știința acceptă constanta Boltzmann ca un dat al lumii noastre și o folosește pentru o descriere teoretică a fizicului. procesele care au loc în ea.
Sensul fizic: Constanta de gaz i este numeric egal cu munca de dilatare a unui mol de gaz ideal într-un proces izobaric cu o creștere a temperaturii cu 1 K
În sistemul GHS, constanta gazului este egală cu:
Constanta specifică a gazului este egală cu:
În formula am folosit:
Constanta universală de gaz (constanta lui Mendeleev)
constanta lui Boltzmann
numărul lui Avogadro
Legea lui Avogadro - volume egale de gaze diferite la temperatură și presiune constante conțin același număr de molecule.
Două corolare sunt derivate din legea lui Avogadro:
Corolarul 1: Un mol din orice gaz în aceleași condiții ocupă același volum
În special, în condiții normale (T=0 °C (273K) și p=101,3 kPa), volumul unui mol de gaz este de 22,4 litri. Acest volum se numește volumul molar al gazului Vm. Această valoare poate fi recalculată la alte temperaturi și presiuni folosind ecuația Mendeleev-Clapeyron
1) Legea lui Charles:
2) Legea lui Gay-Lussac:
3) Legea Bohl-Mariotte:
Corolarul 2: Raportul maselor de volume egale a două gaze este o valoare constantă pentru aceste gaze
Această valoare constantă se numește densitatea relativă a gazelor și se notează D. Deoarece volumele molare ale tuturor gazelor sunt aceleași (prima consecință a legii lui Avogadro), raportul maselor molare ale oricărei perechi de gaze este, de asemenea, egal cu această constantă. :
În formula am folosit:
Densitatea relativă a gazului
Masele molare
Presiune
Volumul molar
Constanta universală de gaz
Temperatura absolută
Legea lui Boyle-Mariotte - La temperatura și masa constantă a unui gaz ideal, produsul presiunii și volumului acestuia este constant.
Aceasta înseamnă că, pe măsură ce presiunea asupra gazului crește, volumul acestuia scade și invers. Pentru o cantitate constantă de gaz, legea Boyle-Mariotte poate fi interpretată și astfel: la o temperatură constantă, produsul dintre presiune și volum este o valoare constantă. Legea Boyle-Mariotte este strict adevărată pentru un gaz ideal și este o consecință a ecuației Mendeleev-Clapeyron. Pentru gazele reale, legea Boyle-Mariotte este satisfăcută aproximativ. Aproape toate gazele se comportă ca gaze ideale la presiuni nu prea mari și la temperaturi nu prea scăzute.
Pentru a fi mai ușor de înțeles Legea lui Boyle Marriott Să ne imaginăm că stoarceți un balon umflat. Deoarece există suficient spațiu liber între moleculele de aer, puteți cu ușurință, aplicând o forță și lucrând, să comprimați mingea, reducând volumul de gaz din interiorul ei. Aceasta este una dintre principalele diferențe dintre gaz și lichid. Într-o sferă de apă lichidă, de exemplu, moleculele sunt împachetate strâns împreună, ca și cum sferele ar fi umplute cu granule microscopice. Prin urmare, spre deosebire de aer, apa nu se pretează la compresiune elastică.
De asemenea este si:
Legea lui Charles:
Legea lui Gay Lussac:
În lege am folosit:
Presiune într-un vas
Volumul 1 vas
Presiunea în vas 2
Volum 2 vase
Legea lui Gay Lussac - la presiune constantă, volumul unei mase constante de gaz este proporțional cu temperatura absolută
Volumul V al unei mase date de gaz la presiune constantă a gazului este direct proporțional cu modificarea temperaturii
Legea lui Gay-Lussac este valabilă doar pentru gazele ideale; gazele reale se supun acesteia la temperaturi și presiuni departe de valorile critice. Este un caz special al ecuației Clayperon.
De asemenea este si:
Ecuația lui Clapeyron a lui Mendeleev:
Legea lui Charles:
Legea lui Boyle Marriott:
În lege am folosit:
Volumul într-un vas
Temperatura într-un vas
Volumul într-un vas
Temperatura într-un vas
Volumul inițial de gaz
Volumul gazului la temperatura T
Coeficientul de dilatare termică a gazelor
Diferența dintre temperaturile inițiale și cele finale
Legea lui Henry este o lege conform căreia, la o temperatură constantă, solubilitatea unui gaz într-un lichid dat este direct proporțională cu presiunea acestui gaz deasupra soluției. Legea este potrivită doar pentru soluții ideale și presiuni scăzute.
Legea lui Henry descrie procesul de dizolvare a unui gaz într-un lichid. Știm ce lichid în care se dizolvă gazul este din exemplul băuturilor carbogazoase - fără alcool, cu conținut scăzut de alcool, iar la sărbătorile mari - șampanie. Toate aceste băuturi conțin dioxid de carbon dizolvat (formula chimică CO2), un gaz inofensiv utilizat în industria alimentară datorită solubilității sale bune în apă, iar toate aceste băuturi spumează după deschiderea unei sticle sau a unei cutii deoarece gazul dizolvat începe să fie eliberat din lichidul în atmosferă, deoarece după deschiderea unui recipient sigilat presiunea din interior scade.
De fapt, legea lui Henry afirmă un fapt destul de simplu: cu cât presiunea gazului deasupra suprafeței lichidului este mai mare, cu atât este mai dificil ca gazul dizolvat în acesta să fie eliberat. Și acest lucru este complet logic din punctul de vedere al teoriei cinetice moleculare, deoarece o moleculă de gaz, pentru a se elibera de suprafața unui lichid, trebuie să depășească energia coliziunilor cu moleculele de gaz deasupra suprafeței și cu cât este mai mare. presiunea și, în consecință, numărul de molecule din regiunea limită, cu atât mai mare este mai dificil pentru o moleculă dizolvată să depășească această barieră.
În formula am folosit:
Concentrația gazului în soluție în fracțiuni de mol
coeficientul lui Henry
Presiunea parțială a gazului deasupra soluției
Legea radiației lui Kirchhoff - raportul dintre abilitățile de emisie și absorbție nu depinde de natura corpului, este același pentru toate corpurile.
Prin definiție, un corp absolut negru absoarbe toate radiațiile incidente asupra lui, adică pentru el (Absorbtivitatea corpului). Prin urmare, funcția coincide cu emisivitatea
În formula am folosit:
Emisivitatea corpului
Capacitatea de absorbție a corpului
Funcția Kirchhoff
Legea Stefan-Boltzmann - Luminozitatea energetică a unui corp negru este proporțională cu puterea a patra a temperaturii absolute.
Din formulă reiese clar că odată cu creșterea temperaturii, luminozitatea unui corp nu doar crește, ci crește într-o măsură mult mai mare. Dublați temperatura și luminozitatea crește de 16 ori!
Corpurile încălzite emit energie sub formă de unde electromagnetice de diferite lungimi. Când spunem că un corp este „roșu fierbinte”, aceasta înseamnă că temperatura lui este suficient de ridicată pentru ca radiația termică să apară în partea vizibilă a luminii a spectrului. La nivel atomic, radiația rezultă din emisia de fotoni de către atomii excitați.
Pentru a înțelege cum funcționează această lege, imaginați-vă un atom care emite lumină în adâncurile Soarelui. Lumina este absorbită imediat de un alt atom, reemisă de acesta - și astfel transmisă de-a lungul unui lanț de la atom la atom, datorită căruia întregul sistem se află într-o stare echilibru energetic. Într-o stare de echilibru, lumina cu o frecvență strict definită este absorbită de un atom într-un loc simultan cu emisia de lumină de aceeași frecvență de către un alt atom într-un alt loc. Ca urmare, intensitatea luminii a fiecărei lungimi de undă a spectrului rămâne neschimbată.
Temperatura din interiorul Soarelui scade pe măsură ce acesta se îndepărtează de centrul său. Prin urmare, pe măsură ce vă deplasați spre suprafață, spectrul radiației luminoase pare să corespundă unor temperaturi mai ridicate decât temperatura ambiantă. Ca urmare, la re-radiere, conform legea Stefan-Boltzmann, se va produce la energii și frecvențe mai mici, dar în același timp, datorită legii conservării energiei, se va emite un număr mai mare de fotoni. Astfel, în momentul în care va ajunge la suprafață, distribuția spectrală va corespunde temperaturii suprafeței Soarelui (aproximativ 5.800 K) și nu temperaturii din centrul Soarelui (aproximativ 15.000.000 K).
Energia care ajunge la suprafața Soarelui (sau la suprafața oricărui obiect fierbinte) o părăsește sub formă de radiație. Legea Stefan-Boltzmann ne spune exact care este energia emisă.
În formularea de mai sus legea Stefan-Boltzmann se extinde doar la un corp complet negru, care absoarbe toate radiațiile care cad pe suprafața sa. Corpurile fizice reale absorb doar o parte din energia radiației, iar partea rămasă este reflectată de ele, cu toate acestea, modelul conform căruia puterea specifică de radiație de la suprafața lor este proporțională cu T în 4, de regulă, rămâne același în acest sens. Totuși, în acest caz constanta Boltzmann trebuie înlocuită cu un alt coeficient care să reflecte proprietățile unui corp fizic real. Astfel de constante sunt de obicei determinate experimental.
În formula am folosit:
Luminozitatea energetică a corpului
constanta Stefan-Boltzmann
Temperatura absolută
Legea lui Charles - presiunea unei mase date de gaz ideal la volum constant este direct proporțională cu temperatura absolută
Pentru a fi mai ușor de înțeles legea lui Charles, imaginați-vă aerul din interiorul unui balon. La o temperatură constantă, aerul din balon se va extinde sau se va contracta până când presiunea produsă de moleculele sale atinge 101.325 pascali și este egală cu presiunea atmosferică. Cu alte cuvinte, până când pentru fiecare lovitură a unei molecule de aer din exterior, îndreptată în minge, va exista o lovitură similară a unei molecule de aer, îndreptată din interiorul mingii spre exterior.
Dacă scădeți temperatura aerului din minge (de exemplu, punându-l într-un frigider mare), moleculele din interiorul mingii vor începe să se miște mai încet, lovind pereții mingii mai puțin energic din interior. Moleculele aerului exterior vor pune apoi mai multă presiune asupra mingii, comprimându-l, ca urmare, volumul de gaz din interiorul mingii va scădea. Acest lucru se va întâmpla până când creșterea densității gazului compensează scăderea temperaturii, iar apoi echilibrul va fi stabilit din nou.
De asemenea este si:
Ecuația lui Clapeyron a lui Mendeleev:
Legea lui Gay Lussac:
Legea lui Boyle Marriott:
În lege am folosit:
Presiune într-un vas
Temperatura într-un vas
Presiunea în vas 2
Temperatura în vas 2
Prima lege a termodinamicii - Modificarea energiei interne ΔU a unui sistem termodinamic neizolat este egală cu diferența dintre cantitatea de căldură Q transferată sistemului și munca A a forțelor externe
În loc de munca A efectuată de forțele externe asupra unui sistem termodinamic, este adesea mai convenabil să se ia în considerare munca A’ efectuată de sistemul termodinamic asupra corpurilor externe. Deoarece aceste lucrări sunt egale ca valoare absolută, dar opuse ca semn:
Apoi, după o astfel de transformare prima lege a termodinamicii va arata ca:
Prima lege a termodinamicii - Într-un sistem termodinamic neizolat, modificarea energiei interne este egală cu diferența dintre cantitatea de căldură Q primită și munca A’ efectuată de acest sistem
In termeni simpli prima lege a termodinamicii vorbește despre energie care nu poate fi creată singură și nu poate dispărea în neant; este transferată de la un sistem la altul și se transformă de la o formă la alta (mecanic în termic).
O consecință importantă prima lege a termodinamicii este că este imposibil să se creeze o mașină (motor) care să fie capabilă să efectueze lucrări utile fără a consuma energie externă. O astfel de mașină ipotetică a fost numită o mașină cu mișcare perpetuă de primul fel.
constanta Boltzmann ( sau ) - o constantă fizică care definește relația dintre temperatură și energie. Numit după fizicianul austriac Ludwig Boltzmann, care a adus contribuții majore la fizica statistică, în care această constantă joacă un rol cheie. Valoarea sa experimentală în Sistemul Internațional de Unități (SI) este:
J/.
Numerele din paranteze indică eroarea standard în ultimele cifre ale valorii cantității. În sistemul natural de unități Planck, unitatea naturală de temperatură este dată astfel încât constanta lui Boltzmann este egală cu unitatea.
Relația dintre temperatură și energie
Într-un gaz ideal omogen la temperatură absolută , energia pentru fiecare grad de libertate translațional este egală, după cum rezultă din distribuția Maxwell, . La temperatura camerei (300 ) această energie este J sau 0,013 eV. Într-un gaz ideal monoatomic, fiecare atom are trei grade de libertate corespunzând la trei axe spațiale, ceea ce înseamnă că fiecare atom are o energie de .
Cunoscând energia termică, putem calcula viteza pătrată medie a atomilor, care este invers proporțională cu rădăcina pătrată a masei atomice. Viteza pătrată medie la temperatura camerei variază de la 1370 m/s pentru heliu la 240 m/s pentru xenon. În cazul unui gaz molecular, situația devine mai complicată, de exemplu, un gaz diatomic are cinci grade de libertate (la temperaturi scăzute, când vibrațiile atomilor din moleculă nu sunt excitate).
Definiţia entropy
Entropia unui sistem termodinamic este definită ca logaritmul natural al numărului de microstări diferite , corespunzătoare unei stări macroscopice date (de exemplu, o stare cu o energie totală dată).
Factorul de proporționalitate și este constanta lui Boltzmann. Aceasta este o expresie care definește relația dintre microscopic ( ) și stări macroscopice ( ), exprimă ideea centrală a mecanicii statistice.
Fixarea valorii asumate
A XXIV-a Conferință Generală a Greutăților și Măsurilor, desfășurată în perioada 17-21 octombrie 2011, a adoptat o rezoluție în care, în special, se propunea ca viitoarea revizuire a Sistemului Internațional de Unități să fie realizată astfel încât fixați valoarea constantei Boltzmann, după care va fi considerată definită exact. Ca urmare, va fi executat corect egalitate k=1,380 6X 10 −23 J/K. Această presupusă fixare este asociată cu dorința de a redefini unitatea de temperatură termodinamică kelvin, conectând valoarea acesteia cu valoarea constantei lui Boltzmann.
Vezi si
Scrieți o recenzie despre articolul „Constanta lui Boltzmann”
Note
| Acesta este un proiect de articol despre termodinamică și fizică statistică. Puteți ajuta proiectul adăugând la el. |
Un fragment care caracterizează Constanta lui Boltzmann
— Dar ce înseamnă asta? – spuse Natasha gânditoare.- Oh, nu știu cât de extraordinare sunt toate acestea! - spuse Sonya, strângându-se de cap.
Câteva minute mai târziu, a sunat prințul Andrei, iar Natașa a intrat să-l vadă; iar Sonya, trăind o emoție și o tandrețe pe care rareori le trăise, rămase la fereastră, gândindu-se la natura extraordinară a ceea ce se întâmplase.
În această zi a existat ocazia de a trimite scrisori armatei, iar contesa a scris o scrisoare fiului ei.
— Sonya, spuse Contesa, ridicând capul din scrisoare în timp ce nepoata ei trecea pe lângă ea. – Sonya, nu vrei să-i scrii lui Nikolenka? – spuse contesa cu o voce liniştită, tremurândă, iar în privirea ochilor ei obosiţi, privind prin ochelari, Sonya a citit tot ce a înţeles contesa în aceste cuvinte. Această privire exprima rugăciune, teamă de refuz, rușine pentru a fi nevoit să ceară și disponibilitatea pentru o ură ireconciliabilă în caz de refuz.
Sonya se apropie de contesă și, îngenuncheată, îi sărută mâna.
— O să scriu, mamă, spuse ea.
Sonya a fost înmuiată, încântată și atinsă de tot ce s-a întâmplat în acea zi, în special de performanța misterioasă de ghicire pe care tocmai a văzut-o. Acum că știa că, cu ocazia reînnoirii relației Natasha cu Prințul Andrei, Nikolai nu se putea căsători cu Prințesa Marya, a simțit cu bucurie revenirea acelei dispoziții de sacrificiu de sine în care iubea și era obișnuită să trăiască. Și cu lacrimi în ochi și cu bucuria de a realiza o faptă generoasă, ea, întreruptă de câteva ori de lacrimi care i-au întunecat ochii negri, catifelați, a scris acea scrisoare înduioșătoare, a cărei primire l-a uimit atât de mult pe Nikolai.
La corpul de gardă unde a fost dus Pierre, ofițerul și soldații care l-au luat l-au tratat cu ostilitate, dar în același timp cu respect. Se putea simți încă în atitudinea lor față de el îndoială cu privire la cine este (dacă era o persoană foarte importantă) și ostilitate din cauza luptei lor personale încă proaspete cu el.
Dar când, în dimineața unei alte zile, a venit tura, Pierre a simțit că pentru noua gardă - pentru ofițeri și soldați - nu mai avea sensul pe care îl avea pentru cei care l-au luat. Și într-adevăr, în acest om mare și gras în caftan de țăran, gardienii de a doua zi nu l-au mai văzut pe acel om viu care s-a luptat atât de disperat cu tâlharul și cu soldații de escortă și a spus o frază solemnă despre salvarea copilului, dar au văzut doar al șaptesprezecelea dintre cei ținuți din anumite motive, din ordinul celor mai înalte autorități, rușii capturați. Dacă era ceva special la Pierre, era doar înfățișarea lui timidă, atent gânditoare și limba franceză, în care, surprinzător pentru francezi, vorbea bine. În ciuda faptului că în aceeași zi Pierre a fost conectat cu alți suspecți suspecți, deoarece camera separată pe care o ocupa a fost nevoie de un ofițer.
Toți rușii ținuți cu Pierre erau oameni de cel mai jos rang. Și toți, recunoscându-l pe Pierre drept maestru, l-au ocolit, mai ales că vorbea franceză. Pierre a auzit cu tristețe ridicolizarea lui însuși.
În seara următoare, Pierre a aflat că toți acești prizonieri (și probabil inclusiv el însuși) urmau să fie judecați pentru incendiere. În a treia zi, Pierre a fost dus cu alții într-o casă în care stăteau un general francez cu mustață albă, doi colonei și alți francezi cu eșarfe pe mâini. Lui Pierre, împreună cu alții, i s-au pus întrebări despre cine era, cu precizia și certitudinea cu care sunt tratați de obicei inculpații, presupus depășind slăbiciunile umane. unde a fost? cu ce scop? și așa mai departe.
Aceste întrebări, lăsând deoparte esența chestiunii vieții și excluzând posibilitatea dezvăluirii acestei esențe, ca toate întrebările puse în instanțe, aveau ca scop doar să creeze șanțul pe care judecătorii au dorit să curgă răspunsurile inculpatului și să-l conducă la scopul dorit, adică la acuzare. De îndată ce a început să spună ceva care nu satisface scopul acuzației, au luat un șanț, iar apa putea curge oriunde dorea. În plus, Pierre a experimentat același lucru pe care îl trăiește un inculpat în toate instanțele: nedumerire de ce i-au fost puse toate aceste întrebări. Simțea că acest truc de a introduce un șanț era folosit doar din condescendență sau, parcă, din politețe. Știa că este în puterea acestor oameni, că numai puterea îl adusese aici, că numai puterea le dădea dreptul de a cere răspunsuri la întrebări, că singurul scop al acestei întâlniri era să-l acuze. Și prin urmare, din moment ce exista putere și exista dorința de a acuza, nu era nevoie de trucul întrebărilor și al procesului. Era evident că toate răspunsurile trebuiau să ducă la vinovăție. Întrebat ce face când l-au luat, Pierre a răspuns cu o tragedie că duce un copil la părinții săi, qu"il avait sauve des flammes [pe care l-a salvat de la flăcări]. - De ce s-a luptat cu tâlharul Pierre a răspuns, că apăra o femeie, că protejarea unei femei insultate este datoria oricărei persoane, că... A fost oprit: asta nu a mers la obiect. De ce era în curtea unei case în flăcări. , unde l-au văzut martorii? A răspuns că urmează să vadă ce se întâmplă la Moscova. L-au oprit din nou: nu l-au întrebat unde se duce, și de ce era lângă foc? Cine era? Au repetat prima intrebare catre el, la care a spus ca nu vrea sa raspunda.Din nou i-a raspuns ca nu poate spune ca .
Pentru o constantă legată de energia radiației corpului negru, vezi Constanta Stefan-Boltzmann
|
Valoare constantă k |
Dimensiune |
|
1,380 6504(24) 10 −23 |
|
|
8,617 343(15) 10 −5 |
|
|
1,3807 10 −16 |
|
|
Vezi și mai jos Valori în diferite unități. |
|
constanta lui Boltzmann (k sau k B) este o constantă fizică care determină relația dintre temperatura unei substanțe și energia mișcării termice a particulelor acestei substanțe. Numit după fizicianul austriac Ludwig Boltzmann, care a adus contribuții majore la fizica statistică, în care această constantă joacă un rol cheie. Valoarea sa experimentală în sistemul SI este
În tabel, ultimele numere din paranteze indică eroarea standard a valorii constante. În principiu, constanta lui Boltzmann poate fi obținută din definiția temperaturii absolute și a altor constante fizice. Cu toate acestea, calcularea cu precizie a constantei lui Boltzmann folosind primele principii este prea complexă și imposibil de realizat cu starea actuală a cunoștințelor.
Constanta lui Boltzmann poate fi determinată experimental folosind legea lui Planck a radiației termice, care descrie distribuția energiei în spectrul radiației de echilibru la o anumită temperatură a corpului emițător, precum și alte metode.
Există o relație între constanta universală a gazelor și numărul lui Avogadro, din care rezultă valoarea constantei lui Boltzmann:
Dimensiunea constantei lui Boltzmann este aceeași cu cea a entropiei.
|
Poveste
În 1877, Boltzmann a fost primul care a conectat entropia și probabilitatea, dar o valoare destul de precisă a constantei k ca coeficient de cuplare în formula pentru entropie a apărut doar în lucrările lui M. Planck. Când a derivat legea radiației corpului negru, Planck în 1900–1901. pentru constanta Boltzmann, a găsit o valoare de 1,346 10 −23 J/K, cu aproape 2,5% mai mică decât valoarea acceptată în prezent.
Înainte de 1900, relațiile care se scriu acum cu constanta Boltzmann erau scrise folosind constanta gazului R, iar în locul energiei medii pe moleculă s-a folosit energia totală a substanței. Formula laconică a formei S = k Buturuga W pe bustul lui Boltzmann a devenit astfel datorită lui Planck. În prelegerea sa Nobel din 1920, Planck a scris:
Această constantă este adesea numită constanta lui Boltzmann, deși, din câte știu, Boltzmann însuși nu a introdus-o niciodată - o stare de lucruri ciudată, în ciuda faptului că afirmațiile lui Boltzmann nu vorbeau despre măsurarea exactă a acestei constante.
Această situație poate fi explicată prin dezbaterea științifică în curs de desfășurare la acea vreme pentru a clarifica esența structurii atomice a materiei. În a doua jumătate a secolului al XIX-lea, a existat un dezacord considerabil cu privire la faptul dacă atomii și moleculele erau reale sau doar un mod convenabil de a descrie fenomenele. De asemenea, nu a existat un consens cu privire la faptul dacă „moleculele chimice” distinse prin masa lor atomică erau aceleași molecule ca în teoria cinetică. Mai departe, în prelegerea Nobel a lui Planck, puteți găsi următoarele:
„Nimic nu poate demonstra mai bine rata pozitivă și accelerată a progresului decât arta experimentului în ultimii douăzeci de ani, când au fost descoperite simultan multe metode pentru măsurarea masei moleculelor cu aproape aceeași precizie ca măsurarea masei unei planete. ”
Ecuația de stare a gazelor ideale
Pentru un gaz ideal, legea unificată a gazelor referitoare la presiune este valabilă P, volum V, cantitate de substanță nîn moli, constantă de gaz R si temperatura absoluta T:
În această egalitate, puteți face o înlocuire. Apoi legea gazelor va fi exprimată în termeni de constantă Boltzmann și de numărul de molecule Nîn volum de gaz V:
Relația dintre temperatură și energie
Într-un gaz ideal omogen la temperatură absolută T, energia pentru fiecare grad de libertate translațional este egală, după cum rezultă din distribuția Maxwell, kT/ 2 . La temperatura camerei (≈ 300 K) această energie este ![]() J sau 0,013 eV.
J sau 0,013 eV.
Relații de termodinamică a gazelor
Într-un gaz ideal monoatomic, fiecare atom are trei grade de libertate, corespunzătoare a trei axe spațiale, ceea ce înseamnă că fiecare atom are o energie de 3 kT/ 2 . Acest lucru este de acord cu datele experimentale. Cunoscând energia termică, putem calcula viteza pătrată medie a atomilor, care este invers proporțională cu rădăcina pătrată a masei atomice. Viteza pătrată medie la temperatura camerei variază de la 1370 m/s pentru heliu la 240 m/s pentru xenon.
Teoria cinetică oferă o formulă pentru presiunea medie P gaz ideal:
![]()
Având în vedere că energia cinetică medie a mișcării rectilinie este egală cu:
![]()
găsim ecuația de stare a unui gaz ideal:
Această relație este valabilă pentru gazele moleculare; cu toate acestea, dependența capacității termice se modifică, deoarece moleculele pot avea grade interne suplimentare de libertate în raport cu acele grade de libertate care sunt asociate cu mișcarea moleculelor în spațiu. De exemplu, un gaz diatomic are deja aproximativ cinci grade de libertate.
Multiplicator Boltzmann
În general, sistemul este în echilibru cu un rezervor termic la o temperatură T are o probabilitate p ocupa o stare de energie E, care poate fi scris folosind multiplicatorul Boltzmann exponențial corespunzător:
![]()
Această expresie implică cantitatea kT cu dimensiunea energiei.
Calculul probabilității este utilizat nu numai pentru calcule în teoria cinetică a gazelor ideale, ci și în alte domenii, de exemplu în cinetica chimică în ecuația Arrhenius.
Rolul în determinarea statistică a entropiei
articolul principal: Entropia termodinamică
Entropie S a unui sistem termodinamic izolat în echilibru termodinamic se determină prin logaritmul natural al numărului de microstări diferite. W, corespunzătoare unei stări macroscopice date (de exemplu, o stare cu o energie totală dată E):
![]()
Factorul de proporționalitate k este constanta lui Boltzmann. Aceasta este o expresie care definește relația dintre stările microscopice și macroscopice (via Wși entropia Sîn consecință), exprimă ideea centrală a mecanicii statistice și este principala descoperire a lui Boltzmann.
Termodinamica clasică folosește expresia Clausius pentru entropie:
![]()
Astfel, apariția constantei Boltzmann k poate fi văzută ca o consecință a conexiunii dintre definițiile termodinamice și cele statistice ale entropiei.
Entropia poate fi exprimată în unități k, care dă următoarele:
În astfel de unități, entropia corespunde exact entropiei informaționale.
Energia caracteristică kT egală cu cantitatea de căldură necesară pentru a crește entropia S„pentru un nat.
Rolul în fizica semiconductorilor: stres termic
Spre deosebire de alte substanțe, în semiconductori există o dependență puternică a conductivității electrice de temperatură:
unde factorul σ 0 depinde destul de slab de temperatură în comparație cu exponențial, E A– energia de activare a conducerii. Densitatea electronilor de conducție depinde, de asemenea, exponențial de temperatură. Pentru curentul printr-o joncțiune p-n semiconductoare, în loc de energia de activare, luați în considerare energia caracteristică a unei joncțiuni p-n date la temperatură T ca energia caracteristică a unui electron într-un câmp electric:
Unde q- , A V T exista stres termic in functie de temperatura.
Această relație stă la baza exprimării constantei Boltzmann în unități de eV∙K −1. La temperatura camerei (≈ 300 K) valoarea tensiunii termice este de aproximativ 25,85 milivolți ≈ 26 mV.
În teoria clasică, este adesea folosită o formulă, conform căreia viteza efectivă a purtătorilor de sarcină dintr-o substanță este egală cu produsul dintre mobilitatea purtătorului μ și puterea câmpului electric. O altă formulă leagă densitatea fluxului purtătorului de coeficientul de difuzie Dși cu un gradient de concentrație de purtător n :
![]()
Conform relației Einstein-Smoluchowski, coeficientul de difuzie este legat de mobilitate:
![]()
constanta lui Boltzmann k este inclusă și în legea Wiedemann-Franz, conform căreia raportul dintre coeficientul de conductivitate termică și coeficientul de conductivitate electrică din metale este proporțional cu temperatura și pătratul raportului dintre constantea Boltzmann și sarcina electrică.
Aplicații în alte domenii
Pentru a delimita regiunile de temperatură în care comportamentul materiei este descris prin metode cuantice sau clasice, se utilizează temperatura Debye:
![]()
Unde - , ![]() este frecvența limită a vibrațiilor elastice ale rețelei cristaline, u– viteza sunetului într-un solid, n– concentrația de atomi.
este frecvența limită a vibrațiilor elastice ale rețelei cristaline, u– viteza sunetului într-un solid, n– concentrația de atomi.
Conform legii Stefan-Boltzmann, densitatea radiației semisferice integrale E 0 depinde numai de temperatură și variază proporțional cu puterea a patra a temperaturii absolute T:
Constanta Stefan–Boltzmann σ 0 este o constantă fizică inclusă în legea care determină densitatea volumetrică a radiației termice de echilibru a unui corp absolut negru:

Din punct de vedere istoric, legea Stefan-Boltzmann a fost formulata inaintea legii radiatiei lui Planck, din care rezulta ca o consecinta. Legea lui Planck stabilește dependența densității fluxului spectral al radiației E 0 pe lungimea de undă λ și temperatură T:

unde λ – lungimea de undă, m; Cu=2,998 10 8 m/s – viteza luminii în vid; T– temperatura corpului, K;
h= 6,625 ×10 -34 J×s – constanta lui Planck.
Constanta fizica k, egal cu raportul constantei universale a gazului R=8314J/(kg×K) la numărul lui Avogadro N / A.=6,022× 10 26 1/(kg×mol):
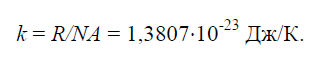
Numărul de configurații de sistem diferite de la N particule pentru un anumit set de numere n i(numărul de particule în i-starea căreia îi corespunde energia e i) este proporţională cu valoarea:

Magnitudinea W există o serie de moduri de distribuire N particule după nivelurile de energie. Dacă relația (6) este adevărată, atunci se consideră că sistemul original se supune statisticilor Boltzmann. Set de numere n i, la care numărul W maxim, apare cel mai frecvent și corespunde distribuției cele mai probabile.
Cinetica fizică– teoria microscopică a proceselor în sisteme de neechilibru statistic.
Descrierea unui număr mare de particule poate fi realizată cu succes folosind metode probabilistice. Pentru un gaz monoatomic, starea unui set de molecule este determinată de coordonatele acestora și de valorile proiecțiilor vitezei pe axele de coordonate corespunzătoare. Matematic, aceasta este descrisă de funcția de distribuție, care caracterizează probabilitatea ca o particulă să se afle într-o stare dată:

este numărul așteptat de molecule dintr-un volum d d ale cărui coordonate sunt în intervalul de la +d și ale căror viteze sunt în intervalul de la +d.
Dacă energia potențială medie în timp a interacțiunii moleculelor poate fi neglijată în comparație cu energia lor cinetică, atunci gazul se numește ideal. Un gaz ideal se numește gaz Boltzmann dacă raportul dintre lungimea traseului moleculelor din acest gaz și dimensiunea caracteristică a fluxului. L desigur, adică

deoarece lungimea traseului este invers proporțională nd 2(n este densitatea numerică 1/m 3, d este diametrul moleculei, m).
mărimea

numit H-Funcția Boltzmann pentru o unitate de volum, care este asociată cu probabilitatea detectării unui sistem de molecule de gaz într-o stare dată. Fiecare stare corespunde unui anumit număr de celule de umplere cu șase dimensiuni de viteză spațială în care spațiul de fază al moleculelor luate în considerare poate fi împărțit. Să notăm W probabilitatea ca în prima celulă a spațiului luat în considerare să fie molecule N 1, N 2 în a doua etc.
Până la o constantă care determină originea probabilității, este valabilă următoarea relație:
 ,
,
Unde 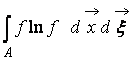 – Funcția H a unei regiuni a spațiului A ocupat de gaz. Din (9) este clar că WȘi H interconectate, adică o modificare a probabilității unei stări duce la o evoluție corespunzătoare a funcției H.
– Funcția H a unei regiuni a spațiului A ocupat de gaz. Din (9) este clar că WȘi H interconectate, adică o modificare a probabilității unei stări duce la o evoluție corespunzătoare a funcției H.

Principiul lui Boltzmann stabilește legătura dintre entropie S sistemul fizic și probabilitatea termodinamică W ea afirmă:

(publicat conform publicației: Kogan M.N. Dynamics of a rarefied gas. - M.: Nauka, 1967.)
Vedere generală a CUBULUI:

unde este forța de masă datorată prezenței diferitelor câmpuri (gravitaționale, electrice, magnetice) care acționează asupra moleculei; J– integrală de coliziune. Acest termen al ecuației Boltzmann ia în considerare ciocnirile moleculelor între ele și modificările corespunzătoare ale vitezelor particulelor care interacționează. Integrala de coliziune este o integrală cinci-dimensională și are următoarea structură:

Ecuația (12) cu integrala (13) a fost obținută pentru ciocnirile de molecule în care nu apar forțe tangențiale, i.e. particulele care se ciocnesc sunt considerate a fi perfect netede.
În timpul interacțiunii, energia internă a moleculelor nu se modifică, adică. se presupune că aceste molecule sunt perfect elastice. Considerăm două grupuri de molecule care au viteze și înainte de a se ciocni între ele (coliziune) (Fig. 1), iar după ciocnire, respectiv, viteze și . Diferența de viteză se numește viteză relativă, adică. . Este clar că pentru o coliziune elastică lină . Funcții de distribuție f 1 ", f", f 1 , f descrieți moleculele grupurilor corespunzătoare după și înainte de ciocniri, i.e. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Orez. 1. Ciocnirea a două molecule.
(13) include doi parametri care caracterizează locația moleculelor care se ciocnesc unul față de celălalt: bşi ε; b– distanța de vizare, de ex. cea mai mică distanță pe care moleculele s-ar apropia în absența interacțiunii (Fig. 2); ε se numește parametrul unghiular de coliziune (Fig. 3). Integrarea s-a terminat b de la 0 la ¥ și de la 0 la 2p (două integrale externe din (12)) acoperă întregul plan de interacțiune a forței perpendicular pe vector

Orez. 2. Traiectoria moleculelor.

Orez. 3. Luarea în considerare a interacțiunii moleculelor într-un sistem de coordonate cilindric: z, b, ε
Ecuația cinetică Boltzmann este derivată în baza următoarelor ipoteze și ipoteze.
1. Se crede că au loc în principal ciocniri a două molecule, adică. rolul ciocnirilor a trei sau mai multe molecule simultan este nesemnificativ. Această ipoteză ne permite să folosim o funcție de distribuție cu o singură particule pentru analiză, care mai sus este numită pur și simplu funcție de distribuție. Luarea în considerare a ciocnirii a trei molecule duce la necesitatea utilizării unei funcții de distribuție a două particule în studiu. În consecință, analiza devine semnificativ mai complicată.
2. Asumarea haosului molecular. Se exprimă prin faptul că probabilitățile de detectare a particulei 1 în punctul de fază și a particulei 2 în punctul de fază sunt independente unele de altele.
3. Ciocnirile de molecule cu orice distanță de impact sunt la fel de probabile, adică. funcția de distribuție nu se modifică la diametrul de interacțiune. De remarcat că elementul analizat trebuie să fie mic astfel încât fîn cadrul acestui element nu se modifică, dar în același timp astfel încât fluctuația relativă ~ să nu fie mare. Potențialele de interacțiune utilizate în calcularea integralei de coliziune sunt simetrice sferic, adică ![]() .
.
Distribuția Maxwell-Boltzmann
Starea de echilibru a gazului este descrisă de distribuția Maxwelliană absolută, care este o soluție exactă a ecuației cinetice Boltzmann:

unde m este masa moleculei, kg.
Distribuția Maxwelliană locală generală, altfel numită distribuție Maxwell-Boltzmann:

în cazul în care gazul se mișcă în întregime cu viteza și variabilele n, T depind de coordonată
și timpul t.
În câmpul gravitațional al Pământului, soluția exactă a ecuației Boltzmann arată:

Unde n 0 = densitatea la suprafața Pământului, 1/m3; g– accelerația gravitațională, m/s 2 ; h– înălțime, m. Formula (16) este o soluție exactă a ecuației cinetice Boltzmann fie în spațiu nelimitat, fie în prezența unor limite care nu încalcă această distribuție, în timp ce temperatura trebuie să rămână și ea constantă.
Această pagină a fost concepută de Puzina Yu.Yu. cu sprijinul Fundației Ruse pentru Cercetare de bază - proiect Nr. 08-08-00638.





