Constante k. Ludwig Boltzmann : réalisations personnelles
En tant que science quantitative exacte, la physique ne peut se passer d'un ensemble de constantes très importantes qui sont incluses comme coefficients universels dans les équations qui établissent des relations entre certaines quantités. Ce sont des constantes fondamentales grâce auxquelles de telles relations deviennent invariantes et sont capables d’expliquer le comportement des systèmes physiques à différentes échelles.
Parmi les paramètres qui caractérisent les propriétés inhérentes à la matière de notre Univers se trouve la constante de Boltzmann, une quantité incluse dans plusieurs des équations les plus importantes. Cependant, avant d’envisager ses caractéristiques et sa signification, on ne peut s’empêcher de dire quelques mots sur le scientifique dont il porte le nom.
Ludwig Boltzmann : réalisations scientifiques
L'un des plus grands scientifiques du XIXe siècle, l'Autrichien Ludwig Boltzmann (1844-1906) a apporté une contribution significative au développement de la théorie de la cinétique moléculaire, devenant l'un des créateurs de la mécanique statistique. Il est l'auteur de l'hypothèse ergodique, une méthode statistique de description d'un gaz parfait, et de l'équation de base de la cinétique physique. Il a beaucoup travaillé sur les questions de thermodynamique (théorème H de Boltzmann, principe statistique de la deuxième loi de la thermodynamique), de théorie des rayonnements (loi de Stefan-Boltzmann). Dans ses travaux, il a également abordé certaines questions d'électrodynamique, d'optique et d'autres branches de la physique. Son nom est immortalisé dans deux constantes physiques, qui seront discutées ci-dessous.
Ludwig Boltzmann était un partisan convaincu et constant de la théorie de la structure atomique et moléculaire de la matière. Pendant de nombreuses années, il a dû lutter contre l'incompréhension et le rejet de ces idées dans la communauté scientifique de l'époque, alors que de nombreux physiciens considéraient les atomes et les molécules comme une abstraction inutile, au mieux comme un dispositif conventionnel destiné à faciliter les calculs. Une maladie douloureuse et les attaques de collègues conservateurs ont poussé Boltzmann dans une grave dépression qui, incapable de la supporter, a conduit l'éminent scientifique à se suicider. Sur le monument funéraire, au-dessus du buste de Boltzmann, en signe de reconnaissance de ses mérites, est gravée l'équation S = k∙logW - l'un des résultats de son fructueux travail scientifique. La constante k dans cette équation est la constante de Boltzmann.
Énergie des molécules et température de la matière
La notion de température sert à caractériser le degré d'échauffement d'un corps particulier. En physique, on utilise une échelle de température absolue, basée sur la conclusion de la théorie cinétique moléculaire de la température en tant que mesure reflétant la quantité d'énergie du mouvement thermique des particules d'une substance (c'est-à-dire, bien sûr, l'énergie cinétique moyenne de un ensemble de particules).
Le joule SI et l'erg utilisés dans le système CGS sont des unités trop grandes pour exprimer l'énergie des molécules et, en pratique, il était très difficile de mesurer la température de cette manière. Une unité de température pratique est le degré, et la mesure est effectuée indirectement, en enregistrant les caractéristiques macroscopiques changeantes d'une substance, par exemple le volume.

Quel est le rapport entre l’énergie et la température ?
Pour calculer les états de la matière réelle à des températures et des pressions proches de la normale, on utilise avec succès le modèle d'un gaz parfait, c'est-à-dire dont la taille moléculaire est bien inférieure au volume occupé par une certaine quantité de gaz et à la distance entre les particules dépassent considérablement le rayon de leur interaction. Sur la base des équations de la théorie cinétique, l'énergie moyenne de ces particules est déterminée par E av = 3/2∙kT, où E est l'énergie cinétique, T est la température et 3/2∙k est le coefficient de proportionnalité introduit par Boltzmann. Le chiffre 3 caractérise ici le nombre de degrés de liberté de mouvement de translation des molécules dans trois dimensions spatiales.
La valeur k, qui fut plus tard appelée constante de Boltzmann en l'honneur du physicien autrichien, indique la quantité de joule ou d'erg contenant un degré. En d'autres termes, sa valeur détermine dans quelle mesure l'énergie du mouvement chaotique thermique d'une particule d'un gaz idéal monoatomique augmente statistiquement, en moyenne, avec une augmentation de la température de 1 degré.

Combien de fois un degré est-il inférieur à un joule ?
La valeur numérique de cette constante peut être obtenue de différentes manières, par exemple en mesurant la température et la pression absolues, en utilisant l'équation des gaz parfaits ou en utilisant un modèle de mouvement brownien. Au niveau actuel des connaissances, il n’est pas possible de déduire théoriquement cette valeur.
La constante de Boltzmann est égale à 1,38 × 10 -23 J/K (ici K est le kelvin, un degré sur l'échelle absolue de température). Pour un groupe de particules dans 1 mole d'un gaz parfait (22,4 litres), le coefficient reliant l'énergie à la température (constante universelle des gaz) s'obtient en multipliant la constante de Boltzmann par le nombre d'Avogadro (le nombre de molécules dans une mole) : R = kN A, et est de 8,31 J/(mol∙kelvin). Cependant, contrairement à cette dernière, la constante de Boltzmann est de nature plus universelle, puisqu'elle est incluse dans d'autres relations importantes, et sert également à déterminer une autre constante physique.
Distribution statistique des énergies moléculaires
Les états macroscopiques de la matière étant le résultat du comportement d’un grand ensemble de particules, ils sont décrits à l’aide de méthodes statistiques. Ce dernier consiste également à découvrir comment se répartissent les paramètres énergétiques des molécules de gaz :
- Distribution maxwellienne des énergies cinétiques (et vitesses). Cela montre que dans un gaz en état d'équilibre, la plupart des molécules ont des vitesses proches d'une vitesse la plus probable v = √(2kT/m 0), où m 0 est la masse de la molécule.
- Distribution de Boltzmann des énergies potentielles pour les gaz situés dans le champ de toutes forces, par exemple la gravité terrestre. Cela dépend de la relation entre deux facteurs : l’attraction vers la Terre et le mouvement thermique chaotique des particules de gaz. En conséquence, plus l’énergie potentielle des molécules est faible (plus proches de la surface de la planète), plus leur concentration est élevée.

Les deux méthodes statistiques sont combinées dans une distribution de Maxwell-Boltzmann contenant un facteur exponentiel e - E/ kT, où E est la somme des énergies cinétiques et potentielles, et kT est l'énergie moyenne déjà connue du mouvement thermique, contrôlée par la constante de Boltzmann.
Constante k et entropie
D'une manière générale, l'entropie peut être caractérisée comme une mesure de l'irréversibilité d'un processus thermodynamique. Cette irréversibilité est associée à la dissipation – dissipation – de l’énergie. Dans l'approche statistique proposée par Boltzmann, l'entropie est fonction du nombre de façons dont un système physique peut être réalisé sans changer son état : S = k∙lnW.
Ici, la constante k spécifie l'échelle de croissance de l'entropie avec une augmentation de ce nombre (W) d'options de mise en œuvre du système, ou microétats. Max Planck, qui a donné à cette formule sa forme moderne, a suggéré de donner à la constante k le nom de Boltzmann.

Loi de rayonnement de Stefan-Boltzmann
La loi physique qui établit comment la luminosité énergétique (puissance de rayonnement par unité de surface) d'un corps absolument noir dépend de sa température a la forme j = σT 4, c'est-à-dire que le corps émet proportionnellement à la puissance quatrième de sa température. Cette loi est utilisée, par exemple, en astrophysique, car le rayonnement des étoiles a des caractéristiques proches du rayonnement du corps noir.
Dans cette relation, il existe une autre constante, qui contrôle également l’ampleur du phénomène. Il s'agit de la constante de Stefan-Boltzmann σ, qui est d'environ 5,67 × 10 -8 W/(m 2 ∙K 4). Sa dimension inclut les kelvins - ce qui signifie qu'il est clair que la constante de Boltzmann k est également impliquée ici. En effet, la valeur de σ est définie comme (2π 2 ∙k 4)/(15c 2 h 3), où c est la vitesse de la lumière et h est la constante de Planck. Ainsi, la constante de Boltzmann, combinée à d’autres constantes mondiales, forme une quantité qui relie à nouveau l’énergie (puissance) et la température – dans ce cas par rapport au rayonnement.

L'essence physique de la constante de Boltzmann
Il a déjà été noté plus haut que la constante de Boltzmann fait partie des constantes dites fondamentales. Le fait n'est pas seulement que cela nous permet d'établir un lien entre les caractéristiques des phénomènes microscopiques au niveau moléculaire et les paramètres des processus observés dans le macrocosme. Et ce n’est pas tout : cette constante est incluse dans un certain nombre d’équations importantes.
On ignore actuellement s’il existe un principe physique sur la base duquel cela pourrait être théoriquement dérivé. En d’autres termes, il ne résulte de rien que la valeur d’une constante donnée devrait être exactement celle-là. Nous pourrions utiliser d'autres quantités et d'autres unités au lieu de degrés comme mesure du respect de l'énergie cinétique des particules, alors la valeur numérique de la constante serait différente, mais elle resterait une valeur constante. Avec d'autres grandeurs fondamentales de ce type - la vitesse limite c, la constante de Planck h, la charge élémentaire e, la constante gravitationnelle G - la science accepte la constante de Boltzmann comme une donnée de notre monde et l'utilise pour une description théorique de l'environnement physique. les processus qui s'y déroulent.
Signification physique : Constante de gaz i est numériquement égal au travail d'expansion d'une mole d'un gaz parfait dans un processus isobare avec une augmentation de température de 1 K
Dans le système GHS, la constante de Gaz est égale à :
La constante spécifique du gaz est égale à :
Dans la formule que nous avons utilisée :
Constante universelle des gaz (constante de Mendeleïev)
Constante de Boltzmann
Le numéro d'Avogadro
Loi d'Avogadro - Des volumes égaux de gaz différents à température et pression constantes contiennent le même nombre de molécules.
Deux corollaires découlent de la loi d’Avogadro :
Corollaire 1: Une mole de n'importe quel gaz dans les mêmes conditions occupe le même volume
En particulier, dans des conditions normales (T=0 °C (273K) et p=101,3 kPa), le volume d'une mole de gaz est de 22,4 litres. Ce volume est appelé volume molaire du gaz Vm. Cette valeur peut être recalculée pour d'autres températures et pressions à l'aide de l'équation de Mendeleev-Clapeyron.
1) Loi de Charles :
2) Loi de Gay-Lussac :
3) Loi Bohl-Mariotte :
Corollaire 2: Le rapport des masses de volumes égaux de deux gaz est une valeur constante pour ces gaz
Cette valeur constante est appelée densité relative des gaz et est notée D. Puisque les volumes molaires de tous les gaz sont les mêmes (1ère conséquence de la loi d'Avogadro), le rapport des masses molaires de tout couple de gaz est également égal à cette constante. :
Dans la formule que nous avons utilisée :
Densité relative du gaz
Masses molaires
Pression
Volume molaire
Constante du gaz universel
Température absolue
Loi de Boyle-Mariotte - À température et masse constantes d'un gaz parfait, le produit de sa pression et de son volume est constant.
Cela signifie que lorsque la pression sur le gaz augmente, son volume diminue et vice versa. Pour une quantité de gaz constante, la loi de Boyle-Mariotte peut également être interprétée comme suit : à température constante, le produit de la pression et du volume est une valeur constante. La loi de Boyle-Mariotte est strictement vraie pour un gaz parfait et est une conséquence de l'équation de Mendeleev-Clapeyron. Pour les gaz réels, la loi de Boyle-Mariotte est satisfaite approximativement. Presque tous les gaz se comportent comme des gaz parfaits à des pressions ni trop élevées ni à des températures trop basses.
Pour faciliter la compréhension La loi de Boyle Marriott Imaginons que vous serrez un ballon gonflé. Puisqu'il y a suffisamment d'espace libre entre les molécules d'air, vous pouvez facilement, en appliquant une certaine force et en effectuant un certain travail, comprimer la balle, réduisant ainsi le volume de gaz à l'intérieur. C'est l'une des principales différences entre le gaz et le liquide. Dans une bille d’eau liquide, par exemple, les molécules sont étroitement serrées les unes contre les autres, comme si la bille était remplie de pastilles microscopiques. Contrairement à l’air, l’eau ne se prête donc pas à la compression élastique.
Il y a aussi:
La loi de Charles :
Loi de Gay Lussac :
Dans la loi, nous avons utilisé :
Pression dans 1 récipient
Volume de 1 navire
Pression dans le récipient 2
Navires du tome 2
Loi de Gay Lussac : à pression constante, le volume d'une masse constante de gaz est proportionnel à la température absolue
Le volume V d'une masse de gaz donnée à pression de gaz constante est directement proportionnel au changement de température
La loi de Gay-Lussac n'est valable que pour les gaz parfaits ; les gaz réels lui obéissent à des températures et des pressions éloignées des valeurs critiques. C'est un cas particulier de l'équation de Clayperon.
Il y a aussi:
L'équation de Clapeyron de Mendeleev :
La loi de Charles :
Loi de Boyle Marriott :
Dans la loi, nous avons utilisé :
Volume dans 1 récipient
Température dans 1 récipient
Volume dans 1 récipient
Température dans 1 récipient
Volume de gaz initial
Volume de gaz à la température T
Coefficient de dilatation thermique des gaz
Différence entre les températures initiales et finales
La loi de Henry est une loi selon laquelle, à température constante, la solubilité d'un gaz dans un liquide donné est directement proportionnelle à la pression de ce gaz au dessus de la solution. La loi ne convient que pour les solutions idéales et les basses pressions.
La loi de Henry décrit le processus de dissolution d'un gaz dans un liquide. Nous savons ce qu'est un liquide dans lequel le gaz est dissous grâce à l'exemple des boissons gazeuses - non alcoolisées, à faible teneur en alcool et lors des grandes vacances - le champagne. Toutes ces boissons contiennent du dioxyde de carbone dissous (formule chimique CO2), un gaz inoffensif utilisé dans l'industrie alimentaire en raison de sa bonne solubilité dans l'eau, et toutes ces boissons moussent après ouverture d'une bouteille ou d'une canette car le gaz dissous commence à se libérer de le liquide dans l'atmosphère, car après l'ouverture d'un récipient scellé, la pression à l'intérieur chute.
En fait, la loi de Henry énonce un fait assez simple : plus la pression du gaz au-dessus de la surface du liquide est élevée, plus il est difficile pour le gaz dissous de s'échapper. Et c'est tout à fait logique du point de vue de la théorie de la cinétique moléculaire, puisqu'une molécule de gaz, pour se libérer de la surface d'un liquide, doit surmonter l'énergie des collisions avec les molécules de gaz au-dessus de la surface, et plus la plus la pression et, par conséquent, le nombre de molécules dans la région limite sont élevées, plus il est difficile pour une molécule dissoute de surmonter cette barrière.
Dans la formule que nous avons utilisée :
Concentration de gaz en solution en fractions de mole
Coefficient de Henry
Pression partielle du gaz au-dessus de la solution
Loi de Kirchhoff sur le rayonnement - le rapport entre les capacités d'émission et d'absorption ne dépend pas de la nature du corps, il est le même pour tous les corps.
Par définition, un corps absolument noir absorbe tout le rayonnement qui lui tombe dessus, c'est-à-dire pour lui (Absorptivité du corps). La fonction coïncide donc avec l’émissivité
Dans la formule que nous avons utilisée :
Émissivité du corps
Capacité d'absorption du corps
Fonction Kirchhoff
Loi de Stefan-Boltzmann - La luminosité énergétique d'un corps noir est proportionnelle à la puissance quatre de la température absolue.
D'après la formule, il ressort clairement qu'avec l'augmentation de la température, la luminosité d'un corps n'augmente pas seulement, elle augmente dans une bien plus grande mesure. Doublez la température et la luminosité augmente 16 fois !
Les corps chauffés émettent de l'énergie sous forme d'ondes électromagnétiques de différentes longueurs. Lorsque nous disons qu’un corps est « chauffé au rouge », cela signifie que sa température est suffisamment élevée pour que le rayonnement thermique se produise dans la partie visible et lumineuse du spectre. Au niveau atomique, le rayonnement résulte de l'émission de photons par des atomes excités.
Pour comprendre le fonctionnement de cette loi, imaginez un atome émettant de la lumière dans les profondeurs du Soleil. La lumière est immédiatement absorbée par un autre atome, réémise par lui - et ainsi transmise le long d'une chaîne d'atome à atome, grâce à laquelle tout le système est dans un état bilan énergétique. Dans un état d'équilibre, la lumière d'une fréquence strictement définie est absorbée par un atome à un endroit simultanément avec l'émission de lumière de même fréquence par un autre atome à un autre endroit. En conséquence, l’intensité lumineuse de chaque longueur d’onde du spectre reste inchangée.
La température à l’intérieur du Soleil diminue à mesure qu’il s’éloigne de son centre. Ainsi, à mesure que l’on s’approche de la surface, le spectre du rayonnement lumineux semble correspondre à des températures plus élevées que la température ambiante. En conséquence, lors de la réirradiation, selon Loi de Stefan-Boltzmann, cela se produira à des énergies et des fréquences plus basses, mais en même temps, en raison de la loi de conservation de l'énergie, un plus grand nombre de photons sera émis. Ainsi, au moment où elle atteint la surface, la distribution spectrale correspondra à la température de la surface du Soleil (environ 5 800 K) et non à la température au centre du Soleil (environ 15 000 000 K).
L'énergie arrivant à la surface du Soleil (ou à la surface de tout objet chaud) en sort sous forme de rayonnement. La loi de Stefan-Boltzmann nous dit exactement quelle est l'énergie émise.
Dans la formulation ci-dessus Loi de Stefan-Boltzmann ne s'étend qu'à un corps complètement noir, qui absorbe tout le rayonnement tombant sur sa surface. Les corps physiques réels n'absorbent qu'une partie de l'énergie du rayonnement et la partie restante est réfléchie par eux. Cependant, le schéma selon lequel la puissance de rayonnement spécifique de leur surface est proportionnelle à T en 4, en règle générale, reste le même dans ce cas. Cependant, dans ce cas, la constante de Boltzmann doit être remplacée par un autre coefficient qui reflétera les propriétés d'un corps physique réel. Ces constantes sont généralement déterminées expérimentalement.
Dans la formule que nous avons utilisée :
Luminosité énergétique du corps
Constante de Stefan-Boltzmann
Température absolue
Loi de Charles - la pression d'une masse donnée de gaz parfait à volume constant est directement proportionnelle à la température absolue
Pour faciliter la compréhension la loi de Charles, imaginez l'air à l'intérieur d'un ballon. À température constante, l'air dans le ballon se dilatera ou se contractera jusqu'à ce que la pression produite par ses molécules atteigne 101 325 pascals et soit égale à la pression atmosphérique. En d’autres termes, jusqu’à ce que pour chaque coup d’une molécule d’air de l’extérieur, dirigé vers la balle, il y ait un coup similaire d’une molécule d’air, dirigé de l’intérieur de la balle vers l’extérieur.
Si vous abaissez la température de l'air dans la balle (par exemple, en la plaçant dans un grand réfrigérateur), les molécules à l'intérieur de la balle commenceront à se déplacer plus lentement, frappant moins énergiquement les parois de la balle de l'intérieur. Les molécules de l’air extérieur vont alors exercer plus de pression sur le ballon, le comprimant, de ce fait, le volume de gaz à l’intérieur du ballon va diminuer. Cela se produira jusqu'à ce que l'augmentation de la densité du gaz compense la diminution de la température, puis l'équilibre sera à nouveau rétabli.
Il y a aussi:
L'équation de Clapeyron de Mendeleev :
Loi de Gay Lussac :
Loi de Boyle Marriott :
Dans la loi, nous avons utilisé :
Pression dans 1 récipient
Température dans 1 récipient
Pression dans le récipient 2
Température dans la cuve 2
Première loi de la thermodynamique - La variation de l'énergie interne ΔU d'un système thermodynamique non isolé est égale à la différence entre la quantité de chaleur Q transférée au système et le travail A des forces externes
Au lieu du travail A effectué par des forces externes sur un système thermodynamique, il est souvent plus pratique de considérer le travail A’ effectué par le système thermodynamique sur des corps externes. Puisque ces œuvres sont égales en valeur absolue, mais opposées en signe :
Puis après une telle transformation première loi de la thermodynamique ressemblera:
Première loi de la thermodynamique - Dans un système thermodynamique non isolé, la variation d'énergie interne est égale à la différence entre la quantité de chaleur Q reçue et le travail A' effectué par ce système
En termes simples première loi de la thermodynamique parle d'énergie qui ne peut pas être créée seule et disparaître nulle part ; elle est transférée d'un système à un autre et passe d'une forme à une autre (mécanique à thermique).
Une conséquence importante première loi de la thermodynamique est qu'il est impossible de créer une machine (moteur) capable d'effectuer un travail utile sans consommer d'énergie externe. Une telle machine hypothétique était appelée machine à mouvement perpétuel du premier type.
Constante de Boltzmann ( ou ) - une constante physique qui définit la relation entre température et énergie. Nommé d'après le physicien autrichien Ludwig Boltzmann, qui a apporté d'importantes contributions à la physique statistique, dans laquelle cette constante joue un rôle clé. Sa valeur expérimentale dans le Système International d'Unités (SI) est :
J/.
Les nombres entre parenthèses indiquent l'erreur type dans les derniers chiffres de la valeur de la quantité. Dans le système naturel des unités de Planck, l'unité naturelle de température est donnée de telle sorte que la constante de Boltzmann soit égale à l'unité.
Relation entre température et énergie
Dans un gaz parfait homogène à température absolue , l'énergie pour chaque degré de liberté de translation est égale, comme suit la distribution de Maxwell, . A température ambiante (300 ) cette énergie est J, ou 0,013 eV. Dans un gaz parfait monoatomique, chaque atome possède trois degrés de liberté correspondant à trois axes spatiaux, ce qui signifie que chaque atome possède une énergie de .
Connaissant l’énergie thermique, nous pouvons calculer la vitesse quadratique moyenne des atomes, qui est inversement proportionnelle à la racine carrée de la masse atomique. La vitesse quadratique moyenne à température ambiante varie de 1370 m/s pour l'hélium à 240 m/s pour le xénon. Dans le cas d'un gaz moléculaire, la situation devient plus compliquée, par exemple, un gaz diatomique a cinq degrés de liberté (à basse température, lorsque les vibrations des atomes de la molécule ne sont pas excitées).
Définition de l'entropie
L'entropie d'un système thermodynamique est définie comme le logarithme népérien du nombre de microétats différents , correspondant à un état macroscopique donné (par exemple, un état avec une énergie totale donnée).
Facteur de proportionnalité et est la constante de Boltzmann. C'est une expression qui définit la relation entre microscopique ( ) et les états macroscopiques ( ), exprime l'idée centrale de la mécanique statistique.
Fixation de la valeur supposée
La XXIVe Conférence générale des poids et mesures, tenue du 17 au 21 octobre 2011, a adopté une résolution dans laquelle il est notamment proposé que la future révision du Système international d'unités soit réalisée de manière à fixer la valeur de la constante de Boltzmann, après quoi elle sera considérée comme définitive exactement. En conséquence, il sera exécuté exactégalité k=1,380 6X 10 −23 J/K. Cette prétendue fixation est associée à la volonté de redéfinir l'unité de température thermodynamique kelvin, reliant sa valeur à la valeur de la constante de Boltzmann.
voir également
Donnez votre avis sur l'article "Constante de Boltzmann"
Remarques
| Il s'agit d'un projet d'article sur la thermodynamique et la physique statistique. Vous pouvez aider le projet en y ajoutant des éléments. |
Un extrait caractérisant la constante de Boltzmann
- Mais qu'est ce que ça veut dire? – dit Natasha pensivement.- Oh, je ne sais pas à quel point tout cela est extraordinaire ! - dit Sonya en se tenant la tête.
Quelques minutes plus tard, le prince Andrei a appelé et Natasha est venue le voir ; et Sonya, éprouvant une émotion et une tendresse qu'elle avait rarement éprouvées, resta à la fenêtre, méditant sur le caractère extraordinaire de ce qui s'était passé.
Ce jour-là, il y avait une occasion d'envoyer des lettres à l'armée et la comtesse écrivit une lettre à son fils.
« Sonya », dit la comtesse en levant la tête de la lettre alors que sa nièce passait devant elle. – Sonya, tu n'écriras pas à Nikolenka ? - dit la comtesse d'une voix calme et tremblante, et dans le regard de ses yeux fatigués, regardant à travers des lunettes, Sonya lut tout ce que la comtesse comprenait dans ces mots. Ce regard exprimait la supplication, la peur du refus, la honte de devoir demander et la disposition à une haine irréconciliable en cas de refus.
Sonya s'approcha de la comtesse et, s'agenouillant, lui baisa la main.
«Je vais écrire, maman», dit-elle.
Sonya a été adoucie, excitée et touchée par tout ce qui s'est passé ce jour-là, en particulier par la mystérieuse performance de divination qu'elle vient de voir. Maintenant qu'elle savait qu'à l'occasion du renouvellement des relations de Natasha avec le prince Andrei, Nikolai ne pouvait pas épouser la princesse Marya, elle sentait avec joie le retour de cet état d'abnégation dans lequel elle aimait et avait l'habitude de vivre. Et les larmes aux yeux et avec la joie de réaliser un acte généreux, elle, interrompue à plusieurs reprises par des larmes qui obscurcissaient ses yeux noirs de velours, écrivit cette lettre touchante dont la réception étonna tant Nicolas.
Au poste de garde où Pierre a été emmené, l'officier et les soldats qui l'ont emmené l'ont traité avec hostilité, mais en même temps avec respect. On pouvait encore ressentir dans leur attitude à son égard un doute sur qui il était (s'il était une personne très importante) et de l'hostilité en raison de leur lutte personnelle encore fraîche avec lui.
Mais quand, un autre matin, le changement arriva, Pierre sentit que pour la nouvelle garde – pour les officiers et les soldats – cela n'avait plus le sens qu'il avait pour ceux qui l'avaient pris. Et en effet, dans ce grand et gros homme en caftan de paysan, les gardes du lendemain n'ont plus vu cet homme vivant qui s'est battu si désespérément avec le maraudeur et avec les soldats d'escorte et a prononcé une phrase solennelle sur le sauvetage de l'enfant, mais ont vu seul le dix-septième de ceux qui étaient détenus pour une raison quelconque, sur ordre des plus hautes autorités, étaient les Russes capturés. S'il y avait quelque chose de spécial chez Pierre, c'était seulement son apparence timide et profondément réfléchie et la langue française dans laquelle, étonnamment pour les Français, il parlait bien. Malgré le fait que le même jour, Pierre était en contact avec d'autres suspects, car la pièce séparée qu'il occupait était nécessaire à un officier.
Tous les Russes que Pierre gardait étaient des gens du plus bas rang. Et tous, reconnaissant Pierre comme un maître, le boudaient, d'autant plus qu'il parlait français. Pierre entendait avec tristesse le ridicule de lui-même.
Le lendemain soir, Pierre apprend que tous ces prisonniers (et probablement lui-même inclus) vont être jugés pour incendie criminel. Le troisième jour, Pierre fut emmené avec d'autres dans une maison où étaient assis un général français à moustache blanche, deux colonels et d'autres Français avec des foulards sur les mains. Pierre, ainsi que d'autres, ont été interrogés sur qui il était avec la précision et la certitude avec lesquelles les accusés sont habituellement traités, dépassant soi-disant les faiblesses humaines. où il était? dans quel but? et ainsi de suite.
Ces questions, laissant de côté l'essence de la question de la vie et excluant la possibilité de révéler cette essence, comme toutes les questions posées devant les tribunaux, avaient pour seul but de tracer le sillon le long duquel les juges voulaient que les réponses de l'accusé coulent et le conduisent à le but recherché, c'est-à-dire l'accusation. Dès qu'il commençait à dire quelque chose qui ne satisfaisait pas le but de l'accusation, ils prenaient un sillon et l'eau pouvait couler où elle voulait. De plus, Pierre a vécu la même chose qu'un accusé vit devant tous les tribunaux : la perplexité quant au pourquoi toutes ces questions lui ont été posées. Il estimait que cette astuce consistant à insérer un sillon n'était utilisée que par condescendance ou, pour ainsi dire, par politesse. Il savait qu'il était au pouvoir de ces gens, que seul le pouvoir l'avait amené ici, que seul le pouvoir leur donnait le droit d'exiger des réponses aux questions, que le seul but de cette réunion était de l'accuser. Et donc, puisqu’il y avait du pouvoir et qu’il y avait un désir d’accuser, il n’y avait pas besoin de l’astuce des questions et du procès. Il était évident que toutes les réponses devaient conduire à la culpabilité. Lorsqu'on lui a demandé ce qu'il faisait lorsqu'ils l'ont emmené, Pierre a répondu avec une certaine tragédie qu'il portait un enfant à ses parents, qu'il avait sauvé des flammes. - Pourquoi s'est-il battu avec le maraudeur " Pierre a répondu, qu'il défendait une femme, que protéger une femme insultée est le devoir de chacun, que... Il a été arrêté : cela n'allait pas à l'essentiel. Pourquoi était-il dans la cour d'une maison en feu , où des témoins l'ont vu ? Il a répondu qu'il allait voir ce qui se passait à Moscou. Ils l'ont encore arrêté : ils ne lui ont pas demandé où il allait, et pourquoi était-il près du feu ? Qui était-il ? Ils ont répété il lui a posé la première question, à laquelle il a dit qu'il ne voulait pas répondre. Il a encore répondu qu'il ne pouvait pas dire cela.
Pour une constante liée à l'énergie du rayonnement du corps noir, voir Constante de Stefan-Boltzmann
|
Valeur constante k |
Dimension |
|
1,380 6504(24) 10 −23 |
|
|
8,617 343(15) 10 −5 |
|
|
1,3807 10 −16 |
|
|
Voir également Valeurs en différentes unités ci-dessous. |
|
Constante de Boltzmann (k ou k B) est une constante physique qui détermine la relation entre la température d'une substance et l'énergie du mouvement thermique des particules de cette substance. Nommé d'après le physicien autrichien Ludwig Boltzmann, qui a apporté d'importantes contributions à la physique statistique, dans laquelle cette constante joue un rôle clé. Sa valeur expérimentale dans le système SI est
Dans le tableau, les derniers chiffres entre parenthèses indiquent l'erreur type de la valeur constante. En principe, la constante de Boltzmann peut être obtenue à partir de la définition de la température absolue et d'autres constantes physiques. Cependant, calculer avec précision la constante de Boltzmann en utilisant les premiers principes est trop complexe et irréalisable dans l’état actuel des connaissances.
La constante de Boltzmann peut être déterminée expérimentalement à l'aide de la loi du rayonnement thermique de Planck, qui décrit la distribution d'énergie dans le spectre du rayonnement d'équilibre à une certaine température du corps émetteur, ainsi que d'autres méthodes.
Il existe une relation entre la constante universelle des gaz et le nombre d'Avogadro, d'où découle la valeur de la constante de Boltzmann :
La dimension de la constante de Boltzmann est la même que celle de l'entropie.
|
Histoire
En 1877, Boltzmann fut le premier à relier entropie et probabilité, mais une valeur assez précise de la constante k comme coefficient de couplage dans la formule de l'entropie n'est apparu que dans les travaux de M. Planck. En dérivant la loi du rayonnement du corps noir, Planck en 1900-1901. pour la constante de Boltzmann, il a trouvé une valeur de 1,346 10 −23 J/K, soit près de 2,5 % de moins que la valeur actuellement acceptée.
Avant 1900, les relations qui s'écrivent aujourd'hui avec la constante de Boltzmann s'écrivaient en utilisant la constante des gaz R., et au lieu de l'énergie moyenne par molécule, l'énergie totale de la substance a été utilisée. Formule laconique de la forme S = k enregistrer W sur le buste de Boltzmann est devenu tel grâce à Planck. Dans sa conférence Nobel en 1920, Planck écrivait :
Cette constante est souvent appelée constante de Boltzmann, même si, à ma connaissance, Boltzmann lui-même ne l'a jamais introduite - un état de fait étrange, malgré le fait que les déclarations de Boltzmann ne parlaient pas de la mesure exacte de cette constante.
Cette situation peut s'expliquer par le débat scientifique en cours à cette époque pour clarifier l'essence de la structure atomique de la matière. Dans la seconde moitié du XIXe siècle, il y avait des désaccords considérables quant à savoir si les atomes et les molécules étaient réels ou s'il s'agissait simplement d'un moyen pratique de décrire des phénomènes. Il n'y avait pas non plus de consensus sur la question de savoir si les « molécules chimiques » distinguées par leur masse atomique étaient les mêmes que celles de la théorie cinétique. Plus loin dans la conférence Nobel de Planck, on peut trouver ce qui suit :
« Rien ne peut mieux démontrer le rythme positif et accéléré du progrès que l’art de l’expérimentation au cours des vingt dernières années, lorsque de nombreuses méthodes ont été découvertes à la fois pour mesurer la masse des molécules avec presque la même précision que la mesure de la masse d’une planète. »
Équation d'état des gaz parfaits
Pour un gaz parfait, la loi unifiée des gaz relative à la pression est valable P., volume V, une quantité de substance n en moles, constante des gaz R. et température absolue T:
Dans cette égalité, vous pouvez faire une substitution. Ensuite, la loi des gaz sera exprimée en termes de constante de Boltzmann et de nombre de molécules. N en volume de gaz V:
Relation entre température et énergie
Dans un gaz parfait homogène à température absolue T, l'énergie pour chaque degré de liberté de translation est égale, comme suit la distribution de Maxwell, kT/ 2 . A température ambiante (≈ 300 K) cette énergie est ![]() J, ou 0,013 eV.
J, ou 0,013 eV.
Relations thermodynamiques des gaz
Dans un gaz parfait monoatomique, chaque atome possède trois degrés de liberté, correspondant à trois axes spatiaux, ce qui signifie que chaque atome a une énergie de 3 kT/ 2 . Cela concorde bien avec les données expérimentales. Connaissant l’énergie thermique, nous pouvons calculer la vitesse quadratique moyenne des atomes, qui est inversement proportionnelle à la racine carrée de la masse atomique. La vitesse quadratique moyenne à température ambiante varie de 1370 m/s pour l'hélium à 240 m/s pour le xénon.
La théorie cinétique donne une formule pour la pression moyenne P. gaz parfait :
![]()
Considérant que l’énergie cinétique moyenne du mouvement rectiligne est égale à :
![]()
on retrouve l'équation d'état d'un gaz parfait :
Cette relation est valable pour les gaz moléculaires ; cependant, la dépendance de la capacité thermique change, puisque les molécules peuvent avoir des degrés de liberté internes supplémentaires par rapport aux degrés de liberté associés au mouvement des molécules dans l'espace. Par exemple, un gaz diatomique possède déjà environ cinq degrés de liberté.
Multiplicateur de Boltzmann
En général, le système est en équilibre avec un réservoir thermique à une température T a une probabilité p occuper un état d'énergie E, qui peut être écrit en utilisant le multiplicateur exponentiel de Boltzmann correspondant :
![]()
Cette expression implique la quantité kT avec la dimension de l’énergie.
Le calcul de probabilité est utilisé non seulement pour les calculs de la théorie cinétique des gaz parfaits, mais également dans d'autres domaines, par exemple en cinétique chimique dans l'équation d'Arrhenius.
Rôle dans la détermination statistique de l'entropie
Article principal: Entropie thermodynamique
Entropie S d'un système thermodynamique isolé en équilibre thermodynamique est déterminé par le logarithme népérien du nombre de microétats différents W, correspondant à un état macroscopique donné (par exemple, un état avec une énergie totale donnée E):
![]()
Facteur de proportionnalité k est la constante de Boltzmann. C'est une expression qui définit la relation entre les états microscopiques et macroscopiques (via W et l'entropie S en conséquence), exprime l'idée centrale de la mécanique statistique et constitue la principale découverte de Boltzmann.
La thermodynamique classique utilise l'expression de Clausius pour l'entropie :
![]()
Ainsi, l'apparition de la constante de Boltzmann k peut être considérée comme une conséquence du lien entre les définitions thermodynamiques et statistiques de l’entropie.
L'entropie peut être exprimée en unités k, ce qui donne ceci :
Dans de telles unités, l’entropie correspond exactement à l’entropie de l’information.
Énergie caractéristique kTégal à la quantité de chaleur nécessaire pour augmenter l'entropie S"pour un nat.
Rôle en physique des semi-conducteurs : la contrainte thermique
Contrairement à d'autres substances, dans les semi-conducteurs, la conductivité électrique dépend fortement de la température :
où le facteur σ 0 dépend assez faiblement de la température par rapport à l'exponentielle, EA– l’énergie d’activation de conduction. La densité des électrons de conduction dépend également de façon exponentielle de la température. Pour le courant traversant une jonction p-n semi-conductrice, au lieu de l'énergie d'activation, considérons l'énergie caractéristique d'une jonction p-n donnée à la température T comme l'énergie caractéristique d'un électron dans un champ électrique :
Où q- , UN VT il y a un stress thermique en fonction de la température.
Cette relation sert de base à l'expression de la constante de Boltzmann en unités de eV∙K −1. À température ambiante (≈ 300 K), la valeur de la tension thermique est d'environ 25,85 millivolts ≈ 26 mV.
Dans la théorie classique, on utilise souvent une formule selon laquelle la vitesse effective des porteurs de charge dans une substance est égale au produit de la mobilité du porteur μ et de l'intensité du champ électrique. Une autre formule relie la densité de flux porteur au coefficient de diffusion D et avec un gradient de concentration de porteurs n :
![]()
Selon la relation d'Einstein-Smoluchowski, le coefficient de diffusion est lié à la mobilité :
![]()
Constante de Boltzmann k est également inclus dans la loi de Wiedemann-Franz, selon laquelle le rapport du coefficient de conductivité thermique au coefficient de conductivité électrique dans les métaux est proportionnel à la température et au carré du rapport de la constante de Boltzmann à la charge électrique.
Applications dans d'autres domaines
Pour délimiter les régions de température dans lesquelles le comportement de la matière est décrit par des méthodes quantiques ou classiques, la température de Debye est utilisée :
![]()
Où - , ![]() est la fréquence limite des vibrations élastiques du réseau cristallin, toi– vitesse du son dans un solide, n– concentration d'atomes.
est la fréquence limite des vibrations élastiques du réseau cristallin, toi– vitesse du son dans un solide, n– concentration d'atomes.
Selon la loi de Stefan-Boltzmann, la densité du rayonnement hémisphérique intégral E 0 dépend uniquement de la température et varie proportionnellement à la puissance quatre de la température absolue T:
La constante de Stefan – Boltzmann σ 0 est une constante physique incluse dans la loi qui détermine la densité volumétrique du rayonnement thermique d'équilibre d'un corps absolument noir :

Historiquement, la loi de Stefan-Boltzmann a été formulée avant la loi des rayonnements de Planck, dont elle découle. La loi de Planck établit la dépendance de la densité spectrale de flux du rayonnement E 0 sur la longueur d'onde λ et la température T:

où λ – longueur d'onde, m ; Avec=2,998 10 8 m/s – vitesse de la lumière dans le vide ; T– la température corporelle, K ;
h= 6,625 ×10 -34 J×s – constante de Planck.
Constante physique k, égal au rapport de la constante universelle des gaz R.=8314J/(kg×K) au nombre d’Avogadro N / A.=6,022× 10 26 1/(kg×mol) :
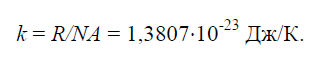
Nombre de configurations système différentes de N particules pour un ensemble de nombres donné n je(nombre de particules dans je-l'état auquel correspond l'énergie e i) est proportionnel à la valeur :

Ordre de grandeur W il existe plusieurs modes de distribution N particules par niveaux d’énergie. Si la relation (6) est vraie, alors on considère que le système original obéit aux statistiques de Boltzmann. Ensemble de nombres n je, auquel le numéro W maximum, se produit le plus fréquemment et correspond à la distribution la plus probable.
Cinétique physique– théorie microscopique des processus dans des systèmes statistiquement hors équilibre.
La description d’un grand nombre de particules peut être réalisée avec succès à l’aide de méthodes probabilistes. Pour un gaz monoatomique, l'état d'un ensemble de molécules est déterminé par leurs coordonnées et les valeurs des projections de vitesse sur les axes de coordonnées correspondants. Mathématiquement, cela est décrit par la fonction de distribution, qui caractérise la probabilité qu'une particule soit dans un état donné :

est le nombre attendu de molécules dans un volume d d dont les coordonnées sont comprises entre et +d et dont les vitesses sont comprises entre et +d.
Si l'énergie potentielle moyenne d'interaction des molécules peut être négligée par rapport à leur énergie cinétique, alors le gaz est appelé idéal. Un gaz parfait est appelé gaz de Boltzmann si le rapport entre la longueur du trajet des molécules dans ce gaz et la taille caractéristique de l'écoulement L bien sûr, c'est-à-dire

parce que la longueur du trajet est inversement proportionnelle ème 2(n est la densité numérique 1/m 3, d est le diamètre de la molécule, m).
Taille

appelé H-Fonction Boltzmann pour une unité de volume, qui est associée à la probabilité de détecter un système de molécules de gaz dans un état donné. Chaque état correspond à un certain nombre de cellules de remplissage à six dimensions espace-vitesse dans lesquelles l'espace des phases des molécules considérées peut être divisé. Notons W la probabilité qu'il y ait N 1 molécules dans la première cellule de l'espace considéré, N 2 dans la seconde, etc.
À une constante près qui détermine l’origine de la probabilité, la relation suivante est valable :
 ,
,
Où 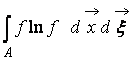 – Fonction H d’une région de l’espace UN occupé par le gaz. D’après (9), il ressort clairement que W Et H interconnectés, c'est-à-dire un changement dans la probabilité d'un état conduit à une évolution correspondante de la fonction H.
– Fonction H d’une région de l’espace UN occupé par le gaz. D’après (9), il ressort clairement que W Et H interconnectés, c'est-à-dire un changement dans la probabilité d'un état conduit à une évolution correspondante de la fonction H.

Le principe de Boltzmann établit le lien entre l'entropie S système physique et probabilité thermodynamique W elle déclare :

(publié d'après la publication : Kogan M.N. Dynamique d'un gaz raréfié. - M. : Nauka, 1967.)
Vue générale du CUBE :

où est la force de masse due à la présence de divers champs (gravitationnel, électrique, magnétique) agissant sur la molécule ; J.– intégrale de collision. C'est ce terme de l'équation de Boltzmann qui prend en compte les collisions de molécules entre elles et les changements correspondants dans les vitesses des particules en interaction. L'intégrale de collision est une intégrale à cinq dimensions et a la structure suivante :

L'équation (12) avec intégrale (13) a été obtenue pour des collisions de molécules dans lesquelles aucune force tangente n'apparaît, c'est-à-dire les particules en collision sont considérées comme parfaitement lisses.
Au cours de l'interaction, l'énergie interne des molécules ne change pas, c'est-à-dire ces molécules sont supposées parfaitement élastiques. Nous considérons deux groupes de molécules qui ont des vitesses et avant d'entrer en collision (collision) (Fig. 1), et après la collision, respectivement, des vitesses et . La différence de vitesse est appelée vitesse relative, c'est-à-dire . Il est clair que pour une collision élastique douce . Fonctions de distribution f 1 ", f", f 1 , f décrire les molécules des groupes correspondants après et avant les collisions, c'est-à-dire ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Riz. 1. Collision de deux molécules.
(13) comprend deux paramètres caractérisant la localisation des molécules en collision les unes par rapport aux autres : b et ε ; b– la distance de visée, c'est-à-dire la plus petite distance que les molécules approcheraient en l'absence d'interaction (Fig. 2) ; ε est appelé paramètre angulaire de collision (Fig. 3). Intégration terminée b de 0 à ¥ et de 0 à 2p (deux intégrales externes dans (12)) couvre tout le plan d'interaction des forces perpendiculaire au vecteur

Riz. 2. La trajectoire des molécules.

Riz. 3. Considération de l'interaction des molécules dans un système de coordonnées cylindriques : z, b, ε
L'équation cinétique de Boltzmann est dérivée des hypothèses et hypothèses suivantes.
1. On pense que se produisent principalement des collisions de deux molécules, c'est-à-dire le rôle des collisions de trois molécules ou plus simultanément est insignifiant. Cette hypothèse nous permet d’utiliser pour l’analyse une fonction de distribution à particule unique, simplement appelée ci-dessus fonction de distribution. La prise en compte de la collision de trois molécules conduit à la nécessité d'utiliser une fonction de distribution à deux particules dans l'étude. En conséquence, l’analyse devient beaucoup plus complexe.
2. Hypothèse de chaos moléculaire. Cela s'exprime par le fait que les probabilités de détection de la particule 1 au point de phase et de la particule 2 au point de phase sont indépendantes l'une de l'autre.
3. Les collisions de molécules avec n'importe quelle distance d'impact sont également probables, c'est-à-dire la fonction de distribution ne change pas au diamètre d'interaction. Il est à noter que l'élément analysé doit être petit pour que F au sein de cet élément ne change pas, mais en même temps de telle sorte que la fluctuation relative ~ ne soit pas grande. Les potentiels d'interaction utilisés dans le calcul de l'intégrale de collision sont à symétrie sphérique, c'est-à-dire ![]() .
.
Distribution Maxwell-Boltzmann
L'état d'équilibre du gaz est décrit par la distribution maxwellienne absolue, qui est une solution exacte de l'équation cinétique de Boltzmann :

où m est la masse de la molécule, kg.
La distribution maxwellienne locale générale, autrement appelée distribution de Maxwell-Boltzmann :

dans le cas où le gaz se déplace dans son ensemble avec la vitesse et les variables n, T dépendent de la coordonnée
et le temps t.
Dans le champ gravitationnel terrestre, la solution exacte de l'équation de Boltzmann montre :

Où n 0 = densité à la surface de la Terre, 1/m3 ; g– accélération de la pesanteur, m/s 2 ; h– hauteur, m. La formule (16) est une solution exacte de l'équation cinétique de Boltzmann soit dans un espace illimité, soit en présence de frontières qui ne violent pas cette distribution, tandis que la température doit également rester constante.
Cette page a été conçue par Puzina Yu.Yu. avec le soutien de la Fondation russe pour la recherche fondamentale - projet n° 08-08-00638.





